2018年,国家药品监督管理局药品审评中心(以下简称药审中心)在国家药品监督管理局(以下简称国家局)坚强领导下,继续贯彻落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号,以下简称42号文件)和国务院《关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号,以下简称44号文件)精神,按照4月12日和6月20日国务院常务会议要求,在鼓励药物研发创新、提高药品质量、保障人民用药安全有效可及等方面开展了一系列工作,以高度的责任感和使命感持续深化药品审评审批制度改革,坚持依法依规、科学规范审评,坚决维护和促进公众健康。
一、药品注册申请受理情况
2018年,药审中心受理新注册申请共7336件(以受理号计,下同),其中需技术审评的注册申请5574件,直接行政审批(无需技术审评,下同)的注册申请1762件。与2017年相比,2018年药审中心需技术审评的注册申请任务受理量大幅增长(较2017年增长了47%),且中药、化药和生物制品各类药品注册申请任务受理量均有较大幅度增长(较2017年分别增长了30%、50%和42%)。
2018年,药审中心受理1类创新药注册申请共264个品种(涉及533件受理号,化药的品种数以活性成分统计,中药和生物制品的品种数均以药品通用名称统计,下同),较2017年增长了21%。其中,受理1类创新药的新药临床试验(IND)申请239个品种,较2017年增长了15%;受理1类创新药的新药上市申请(NDA)25个品种,较2017年增长了150%。
2018年,药审中心受理1类化药创新药注册申请共157个品种,其中,受理1类化药创新药NDA 16个品种,较2017年增长了100%。
2018年,药审中心受理1-6类中药新药注册申请共37个品种,其中,受理中药NDA 8个品种,较2017年增长了7倍;受理中药IND 29个品种,且有1个品种为1类中药创新药IND申请。
2018年,药审中心受理1类生物制品创新药注册申请106个品种(包括预防用生物制品6件,治疗用生物制品117件,共涉及123件受理号),较2017年增长了62%。其中,受理1类生物制品NDA 9个品种(包括预防用生物制品2件,治疗用生物制品9件,共涉及11件受理号),较2017年增长了4.5倍。
(一)总体情况
2018年,药审中心受理的7336件新注册申请中,化药注册申请受理量为5979件,占2018年全部注册申请受理量的82%,2018年各类药品注册申请受理情况与近三年比较详见图1。

需技术审评的5574件注册申请中,化药为4459件,占全部需技术审评的注册申请受理量的80%,中药和生物制品注册申请分别为300件和815件。
(二)国产创新药受理情况
药审中心受理国产1类创新药注册申请448件(涉及222个品种),其中受理临床申请403件(涉及198个品种),上市申请45件(涉及24个品种)。按药品类型统计,化药323件(涉及115个品种),中药2件(涉及1个品种),生物制品123件(涉及106个品种),创新药的适应症主要集中在抗肿瘤、内分泌系统和消化系统领域。
(三)进口药受理情况
药审中心受理5.1类化药进口原研药注册申请75件(涉及50个品种),受理1类进口创新药注册申请85件(涉及42个品种),创新药的适应症主要集中在抗肿瘤、循环系统和消化系统领域。
(四)各类注册申请受理情况
1.化药注册申请受理情况
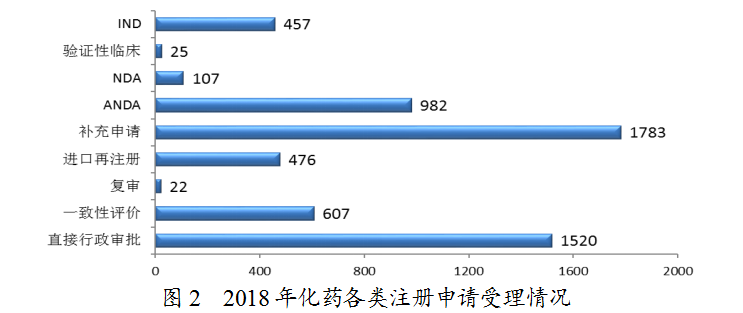
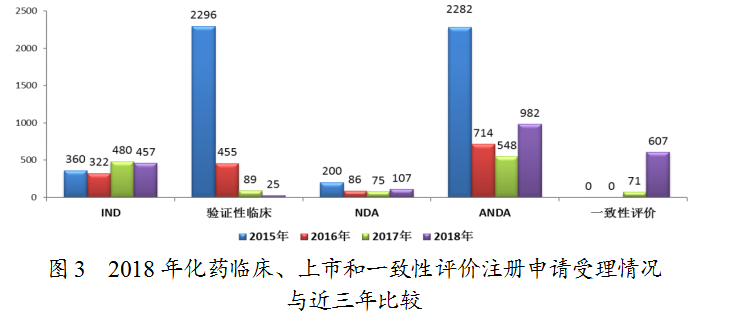
药审中心受理化药注册申请共5979件,其中受理化药NDA申请107件,较2017年增长了43%;受理仿制药上市申请(ANDA)982件,较2017年增长了79%。化药各类注册申请受理情况详见图2。2018年化药临床、上市和一致性评价注册申请受理情况与近三年比较详见图3。
(1)创新药受理情况
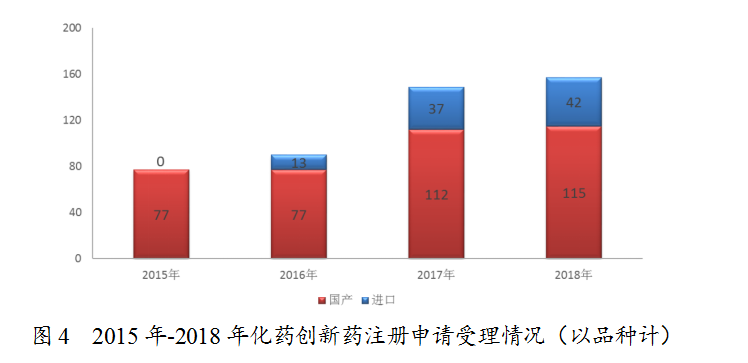
药审中心受理1类化药创新药注册申请157个品种,整体较2017年略有增加,其中受理创新药NDA 16个品种,较2017年增长了一倍。2018年受理的157个化药创新药注册申请中,国产化药创新药注册申请为115个品种,进口化药创新药注册申请为42个品种,2015年至2018年创新药注册申请受理情况详见图4。
(2)化药新药临床试验申请适应症
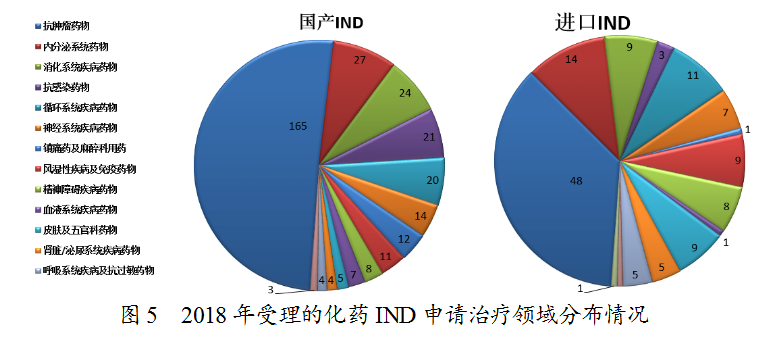
药审中心受理化药IND申请457件,其中受理国产化药IND申请325件,受理进口IND申请132件。国产化药IND申请的适应症主要集中在抗肿瘤、内分泌系统和消化系统领域。进口IND申请的适应症主要集中在抗肿瘤、内分泌系统和循环系统领域,具体治疗领域分布详见图5。
2.中药注册申请受理情况
药审中心受理中药注册申请413件,其中受理中药IND申请31件,受理中药NDA 8件,受理中药ANDA 8件。中药各类注册申请受理情况详见图6。2018年中药临床和上市注册申请受理情况与近三年比较详见图7。
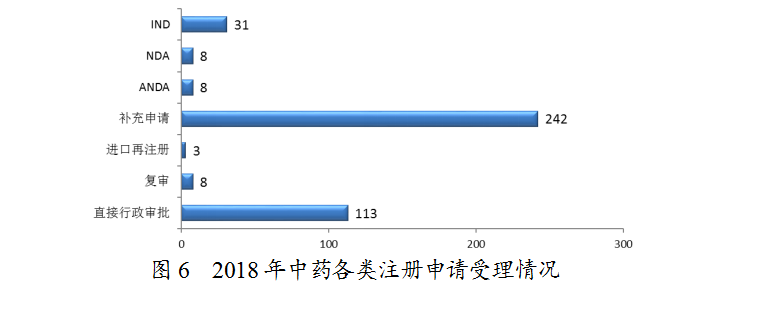

(1)中药新药受理情况
药审中心受理1-6类中药新药注册申请39件,其中受理中药NDA 8件(涉及8个品种),较2017年增长了7倍;中药IND 31件(涉及29个品种),其中1类中药创新药IND申请有2件(涉及1个品种)。
(2)中药新药临床试验申请适应症
药审中心受理中药IND申请31件,主要治疗领域为消化、心血管、呼吸和精神神经,占全部中药IND申请的65%。
3.生物制品注册申请受理情况
药审中心受理生物制品注册申请944件,其中受理生物制品IND申请298件;受理生物制品NDA 85件,较2017年增长了70%。生物制品各类注册申请受理情况详见图8。2018年生物制品临床和上市注册申请受理情况与近三年比较详见图9。
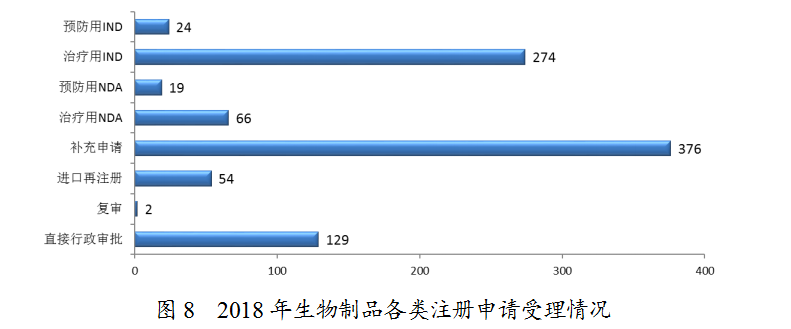

(1)1类生物制品创新药受理情况
药审中心受理1类生物制品创新药注册申请123件(包括预防用生物制品6件,治疗用生物制品117件),较2017年增长了62%。其中,受理1类生物制品NDA 11件(包括预防用生物制品2件,治疗用生物制品9件,共涉及9个品种),较2017年增长了4.5倍;受理1类生物制品IND 112件(包括预防用生物制品4件,治疗用生物制品108件,共涉及97个品种),较2017年增长了51%。
(2)1类治疗用生物制品创新药临床试验申请适应症
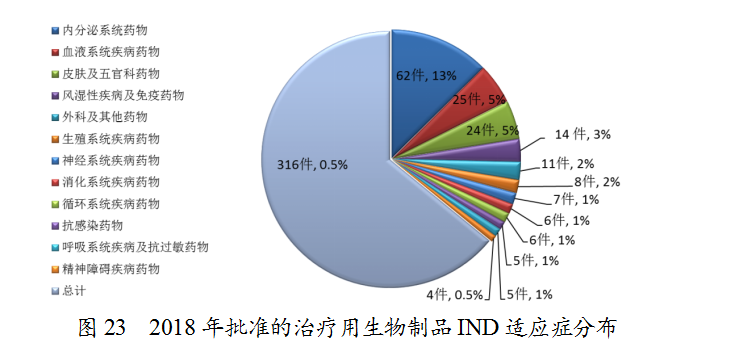
药审中心受理1类治疗用生物制品IND申请108件(涉及93个品种),适应症主要集中在抗肿瘤治疗领域,占全部1类治疗用生物制品IND申请的70%,具体治疗领域分布详见图10。

二、药品注册申请审评审批情况
(一)审评审批总体完成情况
1.全年审评审批完成情况
2018年底,药审中心实现中药、化药、生物制品各类注册申请按时限审评审批率已超过90%,基本完成了44号文件确定2018年实现按规定时限审批的工作目标。全年完成审评审批的注册申请共9796件,其中完成需技术审评的注册申请7988件(包含4052件需技术审评的行政审批任务),完成直接行政审批的注册申请1808件。
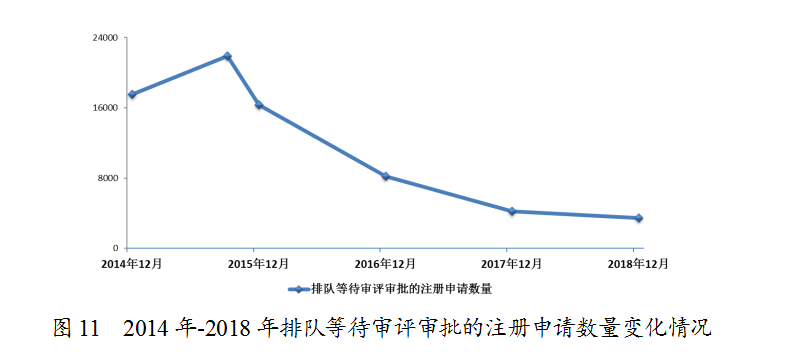
2018年底排队等待审评审批的注册申请已由2015年9月高峰时的近22000件降至3440件(不含完成审评因申报资料缺陷等待申请人回复补充资料的注册申请),进一步巩固了44号文件要求解决注册申请积压的成效。2014年-2018年排队等待审评审批的注册申请数量变化情况详见图11。
完成审评的申请中,化药注册申请为6624件,约占全部审评完成量的83%。2018年各类药品注册申请审评完成情况与近三年比较详见图12。

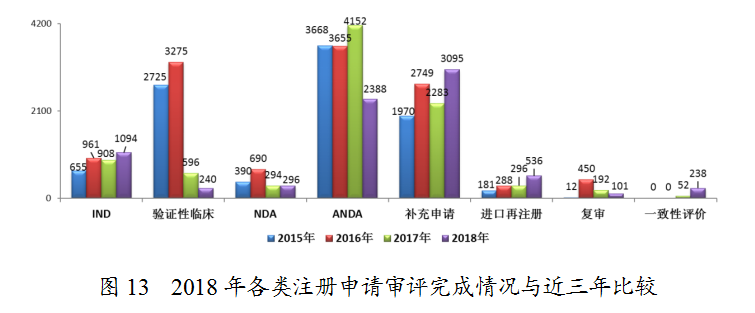
2.各类注册申请审评完成情况
药审中心完成IND申请审评1094件,完成NDA审评296件,完成ANDA审评2388件,2018年各类注册申请审评完成情况与近三年比较详见图13。
3.审评通过情况
2018年,药审中心审评通过批准IND申请947件,审评通过(往年的年度审评报告中表述为“审评通过建议批准”,下同)NDA 175件,审评通过ANDA 1038件。
审评通过上市1类创新药9个品种,审评通过进口原研药67个品种,具体品种详见附件1、2。
(二)化药注册申请审评完成情况
1.总体情况
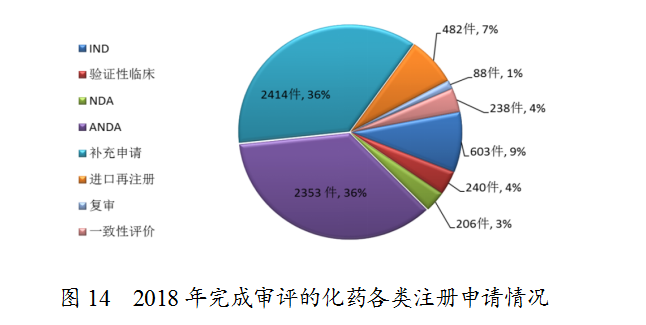
药审中心完成审评的化药注册申请6624件,其中完成化药临床申请(IND和验证性临床)共843件,完成化药NDA 206件,完成化药ANDA 2353件。完成审评的化药各类注册申请情况详见图14。
2.审评通过情况
药审中心完成审评的化药NDA 206件,其中审评通过132件,与前三年比较(以受理号计)详见图15,2018年完成审评的化药各类注册申请具体情况详见表1。

药审中心完成审评的化药IND申请603件,审评通过批准IND申请554件,其中批准1类创新药临床试验申请449件(涉及172个品种)。1类化药创新药临床试验批准数量与前三年比较(以品种计)详见图16。

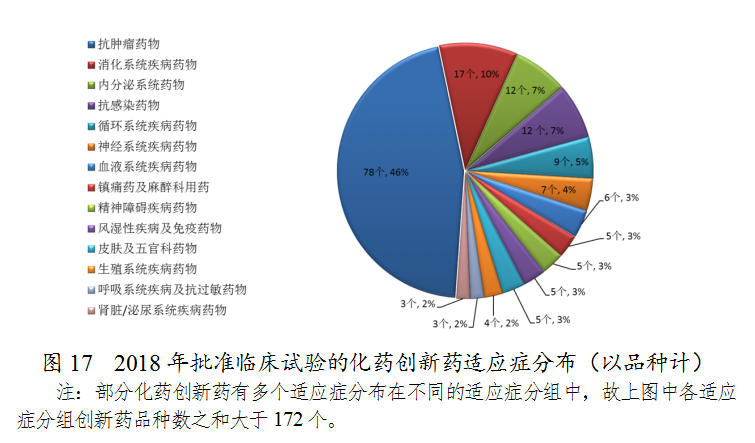
药审中心审评通过批准创新药临床试验的172个品种中,抗肿瘤药物、消化系统药物、内分泌系统药物和抗感染药物较多,占全部创新药临床试验批准数量的68%。批准临床试验的化药创新药适应症分布(以品种计)详见图17。
(三)中药注册申请审评完成情况
1.总体情况
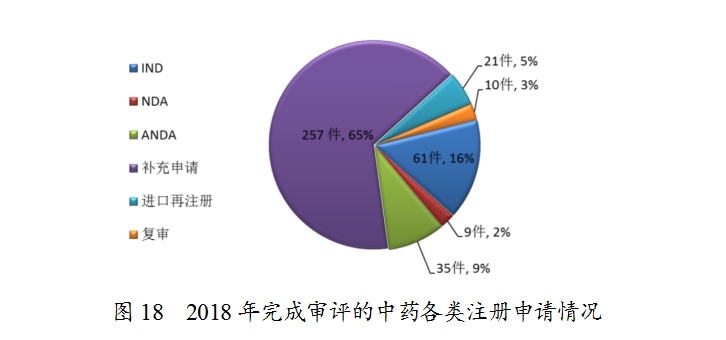
药审中心完成审评的中药注册申请393件,其中完成IND申请61件,完成NDA 9件,完成ANDA 35件。完成审评的中药各类注册申请情况详见图18。
2.审评通过情况
药审中心审评通过批准中药IND申请44件;审评通过中药NDA 2件(涉及2个品种,关黄母颗粒、金蓉颗粒)。完成审评的中药各类注册申请具体情况详见表2,中药IND批准和NDA通过量与前三年比较(以受理号计)详见图19。
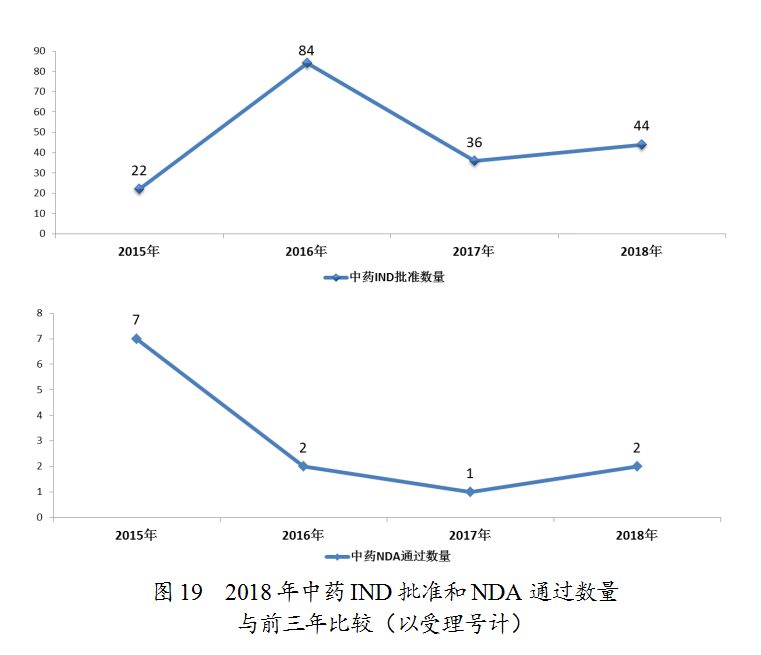

药审中心审评通过批准临床试验的中药IND申请44件,涉及10个适应症领域,其中心血管、精神神经、呼吸较多,共占48%,具体治疗领域分布详见图20。

(四)生物制品注册申请审评完成情况
1.总体情况
药审中心完成审评的生物制品注册申请共971件,其中完成预防用生物制品IND申请(预防用IND)53件,完成治疗用生物制品IND申请(治疗用IND)377件,完成预防用生物制品NDA(预防用NDA)18件,完成治疗用生物制品NDA(治疗用NDA)63件。完成审评的生物制品各类注册申请情况详见图21。
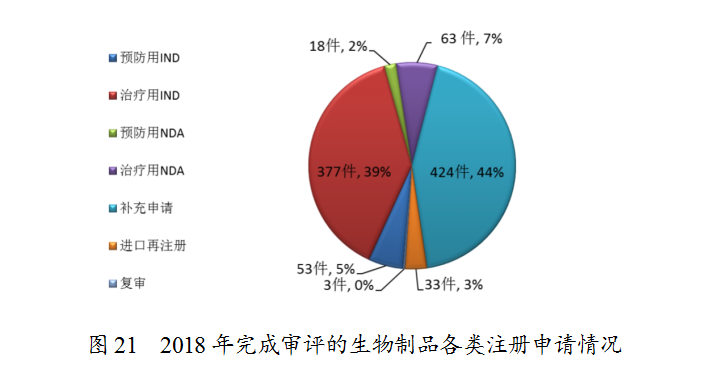
2.审评通过情况
药审中心审评通过批准预防用IND 33件,批准治疗用IND 316件;审评通过预防用NDA 11件、治疗用NDA 30件。2018年完成审评的生物制品各类注册申请具体情况详见表3,生物制品IND批准和NDA通过量与前三年比较(以受理号计)详见图22。
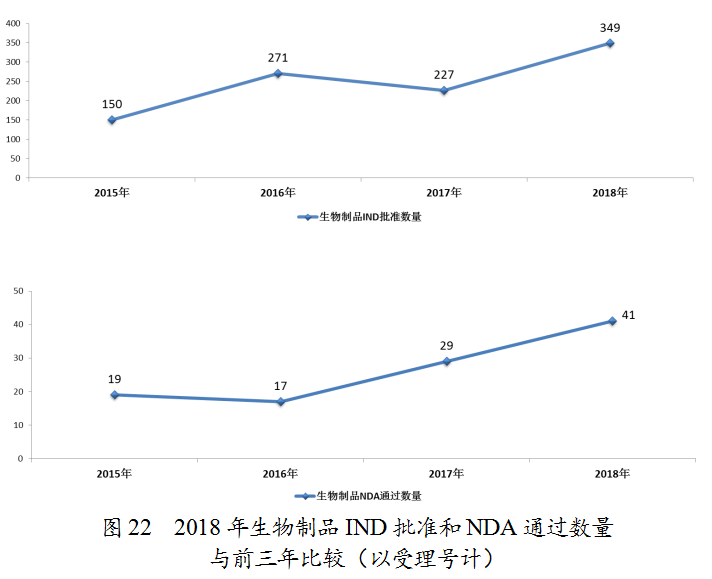

药审中心审评通过批准生物制品IND 349件,其中批准的治疗用生物制品IND治疗领域分布详见图23。
(五)行政审批任务完成情况
2018年,药审中心共完成行政审批任务5860件,其中,完成无需技术审评的直接行政审批任务(即无需技术审评的补充申请)1808件,平均审批时限为12.3个工作日,远小于法定的20日行政审批时限,其中有1656件任务在法定的20日时限内完成,全年平均按时限完成率为92%;完成需技术审评品种的行政审批任务(即临床申请、进口再注册申请、需技术审评的补充申请等)4052件,平均审批时限为18.6个工作日,小于法定的20日行政审批时限,全年平均按时限审批完成率为84%。(注:上述4052件需技术审评的行政审批任务,不包括原辅包关联审评审批实施前已受理完成审评后转原辅包登记平台管理的注册申请任务)。
(六)优先审评纳入情况
1.优先审评品种纳入情况
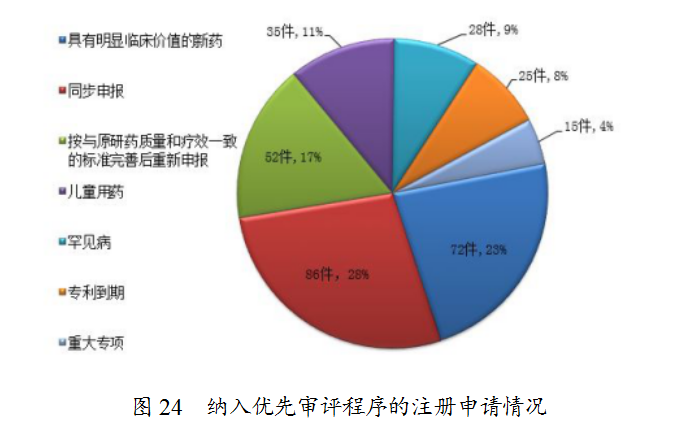
根据国家食品药品监督管理总局(以下简称原总局)《关于鼓励药品创新实行优先审评审批的意见》(食药监药化管〔2017〕126号),2018年,药审中心共将313件注册申请纳入优先审评程序,其中儿童用药和罕见病用药63件。2018年纳入优先审评的注册申请中,同步申报的品种占比最大,占比为28%,其次为具有明显临床价值的新药,占比为23%。纳入优先审评程序的注册申请情况详见图24。
2.优先审评品种审评完成情况
2018年,共有83个品种通过优先审评程序得以加快批准上市(以通用名计算),如自主研发的注射用艾博韦泰、口服丙肝治疗用新药达诺瑞韦钠片、治疗晚期结直肠癌的小分子血管生成抑制剂呋喹替尼胶囊等药品,具体品种名单详见附件3。
(七)沟通交流情况
1.沟通交流总体情况
为进一步为申请人提供便利,药审中心不断丰富沟通交流渠道,提高沟通交流效率和质量,形成了沟通交流会议、网络平台咨询(一般性技术问题)、电话咨询、邮件咨询和现场咨询的多渠道、多层次的沟通交流模式。2018年药审中心接收沟通交流申请1982件,较2017年的840件增长了136%;接收网络平台咨询15219个,较2017年的5881个增长了159%,电话咨询超过上万次,邮件咨询数千次,同时每周三定期开展现场咨询。2017至2018年网络平台咨询和沟通交流申请具体情况见图25。

2.沟通交流会召开情况
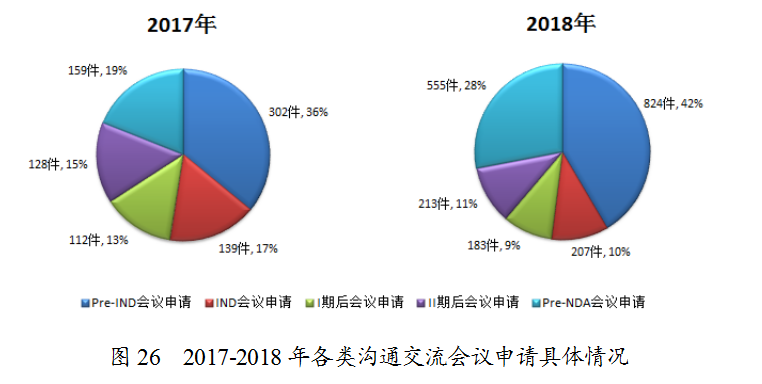
2018年收到沟通交流会议申请1982件,其中Pre-IND会议申请和Pre-NDA会议申请占比例较多,分别为42%和28%。与2017年比较,Pre-IND会议申请和Pre-NDA会议申请所占比例增长较明显,2017至2018年各类沟通交流会议申请具体情况见图26。
根据申请人拟沟通的问题及提交的支持性材料,经审核评估,2018年药审中心召开沟通交流会322次,其余均以书面形式进行了答复,2018年各类沟通交流会议申请及答复情况详见表4。

三、鼓励创新与保障公众用药情况
(一)加快审评重点品种
2018年,药审中心在进一步巩固解决注册申请积压成效和基本实现各类药品注册申请按法定时限审评审批的基础上,通过实施优先审评程序、加强与申请人的沟通交流等措施,一批具有明显临床价值、临床急需等新药好药通过技术审评,为患者提供了更多用药选择。
2018年,药审中心审评通过的新药(NDA及IND直接批产)106个(按品种统计),包含关黄母颗粒、金蓉颗粒2个新中药复方制剂,以及9个1类创新药和67个进口原研药(详见附件1、2)。1类创新药全部为我国自主创新药品且以抗癌药、抗病毒药居多,分别是呋喹替尼胶囊、罗沙司他胶囊、马来酸吡咯替尼片、盐酸安罗替尼胶囊、达诺瑞韦钠片、注射用艾博韦泰6个化学新分子实体药物,特瑞普利单抗注射液、信迪利单抗注射液2个抗PD-1单克隆抗体,以及重组细胞因子基因衍生蛋白注射液。
2018年药审中心审评通过的重点品种有:
抗肿瘤药物:
1.呋喹替尼胶囊,为具有自主知识产权的国产小分子多靶点抗血管生成药物,适用于治疗经过含氟尿嘧啶和铂类化疗后进展的晚期结直肠癌,该药品为晚期肠癌患者提供了更好的治疗手段。
2.盐酸安罗替尼胶囊,为具有自主知识产权的国产小分子多靶点抗血管生成药物,适用于治疗既往经过两种系统方案化疗后出现进展或复发的晚期非小细胞肺癌,该药品为晚期肺癌患者提供了新的治疗选择。
3.马来酸吡咯替尼片,为具有自主知识产权的国产人表皮生长因子受体2(HER-2)小分子酪氨酸激酶抑制剂,适用于治疗HER-2阳性转移性乳腺癌,该药品满足了HER-2阳性晚期乳腺癌患者迫切的临床需求。
4.特瑞普利单抗注射液,为具有自主知识产权的国产首个新型抗肿瘤药物抗PD-1单克隆抗体,适用于治疗既往接受全身系统治疗失败的不可切除或转移性黑色素瘤,该药品满足了晚期黑色素瘤患者迫切的临床需求。
5.信迪利单抗注射液,为具有自主知识产权的国产首个适用于治疗至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤的新型抗肿瘤药物抗PD-1单克隆抗体。目前,全球同类产品有纳武利尤单抗注射液和帕博利珠单抗注射液,我国批准用于治疗非小细胞肺癌、黑色素瘤,但尚未批准其用于治疗淋巴瘤,该药品满足了国内患者的临床需求。
6.帕博利珠单抗注射液,为新型抗肿瘤药物抗PD-1单克隆抗体,适用于治疗一线治疗失败后不可切除或转移性黑色素瘤,该药品为晚期黑色素瘤患者提供了新的治疗手段。
7.纳武利尤单抗注射液,为国内首个新型抗肿瘤药物抗PD-1单克隆抗体,适用于治疗经过含铂化疗后疾病进展的转移性非小细胞肺癌,该药品为晚期肺癌患者提供了更优的治疗选择。
8.盐酸阿来替尼胶囊,为第二代小分子ALK抑制剂,适用于治疗ALK融合基因阳性的转移性非小细胞肺癌。该药品与现有标准治疗相比,具有显著的生存获益(无进展生存期从11个月提高到34.8个月),为ALK阳性晚期肺癌患者提供了突破性的治疗选择。
抗感染药物:
9.索磷布韦维帕他韦片,为国内首个第三代泛基因型直接抗慢性丙型肝炎病毒(HCV)感染的口服复方制剂,适用于治疗基因1至6型、混合型和未知型HCV感染,治愈率高达98%。该药品已入选国家基本药物目录,为我国彻底消灭慢性丙型肝炎提供了有力武器。
10.来迪派韦索磷布韦片,为第二代直接抗HCV感染口服复方制剂,具有广谱抗HCV病毒作用,适用于治疗基因1、4、5、6型HCV感染,该药品为我国慢性丙型肝炎患者提供更多的治愈机会。
11.达诺瑞韦钠片,为具有自主知识产权的国产首个抗HCV口服制剂,适用于与其他药物联合使用,治疗初治的非肝硬化的基因1型慢性丙型肝炎。该药品填补了国内该领域的空白,可降低用药成本,满足HCV患者用药可及性。
12.注射用艾博韦泰,为具有自主知识产权的国产首个抗艾滋病药物,适用于与其它药物联合使用,治疗已接受过抗病毒药物治疗的人类免疫缺陷病毒-1(HIV-1)感染。该药品上市填补了国内该领域的空白,为艾滋病患者提供了新的安全有效的治疗选择。
13.泊沙康唑肠溶片,为咪唑类抗真菌药物,适用于预防13岁和13岁以上患者因重度免疫缺陷而导致侵袭性曲霉菌和念珠菌感染风险增加。目前,深部真菌感染已成为导致癌症、造血干细胞移植、艾滋病等免疫系统受损患者死亡的主要原因,该药品为深部真菌感染的预防与治疗提供了新的选择。
循环系统药物:
14.甲苯磺酸艾多沙班片,为新型抗凝药物,适用于预防伴有一个或多个风险因素的非瓣膜性房颤患者的卒中和体循环栓塞,以及治疗深静脉血栓和肺栓塞以及预防其复发。该药品与现有治疗手段相比,可降低出血风险,为上述患者提供了更优的治疗选择。
15.依洛尤单抗注射液,为国内首个遗传性罕见病纯合子型家族性高胆固醇血症(HoFH)单克隆抗体,适用于与饮食疗法和其他药物联合使用治疗HoFH,降低密度脂蛋白胆固醇(LDL-C)。现有降脂疗法不能有效降低LDL-C,该药品为常规治疗疗效不佳或者不耐受的血脂异常患者提供了新的治疗手段。
16.司来帕格片,为国内首个肺动脉高压(PAH)前列环素类口服制剂,适用于治疗PAH以延缓疾病进展及降低因PAH而住院的风险。目前,PAH仍是一种严重威胁生命的疾病,国内可选择的特异性治疗药物很少,该药品与同类药物相比,在给药方式和耐受性方面更具优势,满足了肺动脉高压患者迫切的临床需求。
血液系统药物:
17.依库珠单抗注射液,为补体蛋白C5特异性抗体,适用于治疗罕见病阵发性睡眠性血红蛋白尿症(PNH)和非典型溶血性尿毒症综合征(aHUS)。该药品是全球唯一获批治疗PNH溶血的药物,为挽救aHUS患者的生命带来突破性改变,属于临床急需产品,对于改善我国PNH和aHUS患者的生存现状具有重大意义。
18.罗沙司他胶囊,为全球首个获批上市具有自主知识产权的国产低氧诱导因子脯氨酸羟化酶(HIF-PH)抑制剂,适用于治疗正在接受透析治疗的患者因慢性肾脏病引起的贫血。该药品具有全新作用机制,与现有常规治疗药物相比,可口服给药,在提高铁利用率、无需静脉补铁等方面具有临床优势。
神经系统药物:
19.拉考沙胺片,为新型抗癫痫药物,适用于16岁及以上癫痫患者部分性发作的联合治疗。该药品与传统抗癫痫药物相比,具有耐药性良好、有效性高、不良反应少的特点,可满足癫痫患者的临床需求。
20.特立氟胺片,为抑制T细胞增殖的新型口服免疫调节剂,适用于治疗复发型多发性硬化症。多发性硬化症是一种终身、慢性、进展性的自身免疫性罕见病,导致中枢神经系统的功能性障碍,该药品与传统治疗药物相比,耐受性良好,为多发性硬化症患者提供了更优选择。
预防用生物制品(疫苗):
21.九价人乳头瘤病毒疫苗(酿酒酵母),适用于预防所包含HPV型别引起的宫颈癌、癌前病变、不典型病变以及持续感染,该药品满足了中国女性对九价HPV疫苗的临床需求。目前全球已上市使用的所有HPV疫苗品种在我国均有供应,能更好地满足公众对疫苗接种的不同需求,为宫颈癌的预防提供了新的有效手段。
中药新药:
22.关黄母颗粒,为新的中药复方制剂,适用于治疗更年期综合征肝肾阴虚证。与已上市的中药相比,该药品在改良Kupperman量表评分的改善等有效性方面有一定临床优势,为更年期综合征女性患者的临床治疗提供了一种更为安全有效的治疗选择。
23.金蓉颗粒,为新的中药复方制剂,适用于治疗乳腺增生病痰瘀互结冲任失调证。该药品为乳腺增生病患者提供了一种新的中医证型的安全有效治疗手段,对于满足患者需求和解决临床可及性具有积极意义。
重大公共卫生用药:
24.四价流感病毒裂解疫苗,为国内首家适用于预防相关型别的流感病毒引起的流行性感冒疫苗。2017年-2018年流感流行季出现的大量流感病例,四价流感疫苗的上市为2018年-2019年流感季的预防接种提供了保障。
25.口服I型III型脊髓灰质炎减毒活疫苗(人二倍体细胞),适用于预防脊髓灰质炎I型和III型病毒导致的脊髓灰质炎。自我国全面停用三价脊髓灰质炎减毒活疫苗后,可用于与脊髓灰质炎灭活疫苗(IPV)序贯接种的二价脊灰减毒活疫苗存在较为严重的供应短缺问题,该药品获批上市为我国脊灰计划免疫程序的顺利实施提供了有力保障。
(二)全力推进仿制药一致性评价
为提升我国仿制药质量,根据44号文件、《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号,以下简称国办8号文件)等有关规定,药审中心全力推进仿制药质量和疗效一致性评价(以下简称一致性评价)工作。
一是全力推进参比制剂的遴选。参比制剂是医药企业开展仿制药一致性评价的关键要素。药审中心针对未公布的参比制剂、存在争议的参比制剂和原研地产化品种申报参比制剂等疑难问题,经详细调研、专家论证等予以解决。2018年正式发布了8批参比制剂目录(221个品规),对于参比制剂发布情况及时整理并发布《289目录品种参比制剂基本情况表》。
二是积极梳理289基药品种情况,明确评价方法。药审中心组织专项工作组,对289基药品种逐一深入的调研,发现品种情况各异,技术复杂,应科学区分不同情况,分类处理,分别施策。经多次会议讨论和广泛征求业界意见,形成《可豁免或简化人体生物等效性(BE)试验品种》(第一批48个品种、第二批14个品种,按通用名统计,下同);经梳理调研并组织企业和一致性评价专家委员会召开多次会议讨论,形成22个品种的《289基药目录中的国内特有品种评价建议》,公开征求意见;经评价,对于建议调出289基药目录的品种,将持续于《国家基本药物目录》(2018年版)中进行动态更新。
三是建立并完善指导原则体系。药审中心起草并于2018年10月29日经国家局发布《生物等效性研究的统计学指导原则》《高变异药物生物等效性研究技术指导原则》。
四是提供多种形式的咨询与培训。药审中心网站开通“仿制药一致性评价专栏”,向社会公开通过一致性评价的品种说明书、企业研究报告及生物等效性试验数据,并采取多种形式加强指导,通过咨询日、申请人之窗、邮件、电话及公文等形式接受咨询,答复2万余条问题,发布《仿制药质量和疗效一致性评价百问百答》,组织召开一致性评价沟通讨论会,解答业界关心的共性问题。
五是优化仿制药生物等效性与临床试验研究信息备案。2018年化学药生物等效性试验备案平台已收集274条信息,仿制药一致性评价生物等效性试验备案平台已收集674条信息,仿制药一致性评价临床有效性试验备案平台已收集2条信息。
通过以上措施,2018年受理口服固体制剂一致性评价申请440件(155个品种),其中289基药品种申请267件(81个品种);通过口服固体制剂一致性评价申请111件(57个品种),其中289基药品种申请63件(36个品种),详见附件4。
(三)积极鼓励中药民族药发展
一是落实药品审评审批改革精神,推动临床急需中药的研发。通过政策引导、沟通交流以及指导原则制修订等工作,中药申报适应症开始向中医药临床优势病种、以及临床缺乏有效治疗手段的适应症和未被满足的临床需求转移。首次申报的新适应症中药新药临床试验申请明显增多,如新生血管性年龄相关性黄斑变性、地中海贫血、中风后抑郁、脊髓型颈椎病、急性单纯性阑尾炎等。中药审评团队积极响应国家加快儿童用药注册申请审批的政策,批准了多个儿科常见病、多发病中药新药的临床研究、增加儿童用药人群等补充申请、儿童用药的改剂型,并积极探索儿童临床试验的研究策略。
二是调整理念,提升中药民族药审评质量。根据药材质量波动较大的特点,推动以饮片均化投料的方式提高中药批间质量的一致性。关注临床试验用样品、毒理试验用样品与大生产样品质量的一致性,重视中药安慰剂的质量。创新民族药审评方式,充分发挥民族药专家的作用,尊重民族药临床用药经验,促进野生中药资源可持续利用。对有明显争议的问题,通过召开第一个中药专家公开论证会的方式,面向社会公开争议双方的技术观点,以科学、公开、公正的态度有效解决分歧争议,树立了审评权威,避免了外界的误解。妥善解决中药舆情事件和历史遗留问题,保障了公众用药安全。
三是加快指导原则体系建设,夯实审评基础。继续建立和完善符合中医药特点的技术评价体系,充分利用业界专家力量,组建专家组负责指导原则的制修订工作,滚动启动了40个中药药学、临床研究技术指导原则,完成并经国家局发布了《中药药源性肝损伤临床评价指导原则》《证候类中药新药临床研究技术指导原则》。起草《古代经典名方中药复方制剂物质基准及制剂的申报资料要求》,支持中药传承。通过不断规范中药临床研究,统一技术审评尺度,传递审评审批改革思路与理念,促进中药产业科学健康发展。
四、主要工作措施及进展情况
(一)持续深化审评审批制度改革
一是落实加快境外已上市临床急需新药审评。为贯彻落实6月20日国务院常务会议要求,药审中心对2007年以来在美国、欧盟或日本批准上市,但尚未在我国境内上市的新药进行梳理,组织专家遴选临床急需新药。现已将第一批48个临床急需境外新药纳入专门通道加快审评(详见附件5),多措并举加大对申请人的服务和指导,上述48个境外新药中已受理17个品种,10个品种已获批上市,7个正在进行技术审评。积极组织开展临床急需境外新药遴选,收到社会各界反馈的临床急需境外新药纳入需求,共涉及100个品种,经初步筛选,建议纳入39个品种,并已上报国家局;起草并由国家局发布《接受药品境外临床试验数据的技术指导原则》《临床急需境外新药审评审批工作程序》及申报资料要求,通过多种沟通交流方式逐一与申请人沟通,主动宣传国家加快临床急需境外新药审评审批政策,对于存在困难的申请人给予指导并帮助其尽快提出注册申请,进一步优化审评程序,加强审评过程中沟通交流,允许申请人滚动提交资料,加快审评速度。
二是落实临床试验默示许可制。按照国家局《关于调整药物临床试验审评审批程序的公告》(2018年第50号,以下简称50号公告)要求,为切实提高临床试验申请审评审批效率,使更多新药能够及早进入临床试验,药审中心制定了《临床试验默示许可审评审批工作程序》,明确了工作流程和要求,同时配套调整了技术审评系统,组织审评人员、申请人等召开临床试验申请座谈会,宣讲解答临床试验默示许可制度相关政策。此外,药审中心还在网站设立专栏,公示并实时更新已发放临床试验通知书的临床申请;积极开展临床试验申请前的沟通交流工作,受理人员、项目管理人、适应症团队与申请人共同参与,确保申报资料的质量,同时受理和审评工作无缝衔接,保障审评工作效率。截至12月底,药审中心在50号公告发布后受理临床试验申请共301件,按照默示许可程序完成审评审批157件,其中发放《临床试验通知书》的临床试验148件(含17件原料药),暂停临床试验8件,申请人主动撤回1件。
三是进一步深化、细化、实化适应症团队、优先审评、沟通交流、立卷审查制度等工作。适应症团队参与申报前沟通交流、受理、立卷及审评审批全过程;优先审评申请采取即到即审方式,组织专家审核确定优先审评品种,2018年已将313件注册申请纳入优先审评程序;修订并由国家局发布《药物研发与技术审评沟通交流管理办法》,优化沟通交流管理平台,召开沟通交流会322次,完善一般性技术问题沟通工作程序,严格非技术性问题解答时限,解答一般性技术问题14389个。
四是实行原辅包与制剂共同审评审批。建立原辅包与制剂共同审评审批工作流程,起草《关于药品制剂所用原料药、药用辅料和药包材登记和关联审评审批有关事宜的公告》并公开征求意见,上线运行原辅包登记与信息公示平台,关联技术审评系统,实现原辅包任务的全流程管理。
五是推进上市药品目录集工作。上线运行上市药品目录集系统,2018年共收录了424个品规,涵盖创新药、改良型新药、进口原研药品、按化药新注册分类批准的仿制药、通过一致性评价的药品等内容。
六是推进改革临床试验管理。为保障受试者健康和安全,建立了药物临床试验期间安全性数据快速报告的标准和程序,构建了接收药物临床试验期间非预期严重不良反应(SUSAR)个例安全性报告(ICSR)的电子传输系统和内部审核流程;启动接收药物研发期间安全性更新报告;结合临床试验过程中可能出现的重大安全性风险情况,起草了《药物临床试验重大安全事件及突发事件应急预案(讨论稿)》;进一步规范药物临床试验管理,加强临床试验信息的公开和透明,提高临床研究质量,2018年在临床试验登记与信息公示平台进行登记并公示的临床试验共有2265个,其中,中药临床试验55个,化药临床试验1832个,生物制品临床试验378个。
七是探索开展合规工作。结合一致性评价工作,提出基于审评需要和风险控制的检查检验原则与标准,探索了以审评为主、检查检验为支撑的工作机制和程序,开展药品注册合规性审查工作,协调审评与检查检验工作,优化衔接流程,搭建核查检验电子文档交换平台,初步实现与核查中心核查检验电子文档的即时传输,完成一致性评价检查检验数据库构建。
(二)加快推进ICH工作办公室工作
2018年6月,国家局在日本神户举行的国际人用药品注册技术协调会(ICH)2018年第一次大会上,当选为ICH管理委员会成员。ICH工作办公室自成立以来,围绕统筹开展国家局ICH工作,积极推进指导原则同国际标准接轨,各项工作均取得一定进展。一是密切保持与国际的交流联络。保障并顺利参与了6月在日本神户和11月在美国夏洛特召开的成员大会、管委会会议和协调员会议,实现了预期工作目标。二是全面保障和参与ICH指导原则国际协调。派遣专家工作组/执行工作组(EWG/IWG)专家41位参与国际指导原则的协调工作;针对ICH正在协调的25个议题,组织主办单位及外部协会成立了25个国内专家工作组,已组织处理的ICH指导原则协调议题共22个。三是重点推进二级指导原则实施工作。协助原总局发布了《总局关于适用国际人用药品注册技术协调会二级指导原则的公告》,跟进并协调《M4:人用药物注册申请通用技术文档(CTD)》和E2A、E2B(R3)的实施工作。四是根据ICH培训目标和培训优先级,通过与第三方的合作开展ICH指导原则的培训,推动ICH指导原则在中国的转化实施,已完成23次培训。五是为便于业界及时了解ICH工作动态,药审中心网站开通“ICH工作办公室专栏”。共设5个栏目,发布ICH工作动态、 指导原则征求意见、实施二级指导原则以及研讨与培训动态等。
(三)进一步加强审评科学基础建设
一是强化审评质量管理,加强对自由裁量权的制约和监督。贯彻落实《药品审评质量管理规范(试行)》,规范药品注册文件勘误工作程序,以勘误工作为抓手,发现审评质量问题并督促改进,强化审评质量意识;持续开展审评质量体系认证工作,用535个文件筑牢质量体系文件基础,加强质量管理人员及内审员队伍建设,完成2018年度ISO9001质量体系再认证工作;有序推进质量体系与审评业务的融合,重点监督按时限完成审评情况、审评审批正确率等关键质量目标,对质量目标完成情况进行测算分析,实现日常化质量管理的工作机制。二是加强审评技术指导原则体系建设,起草经国家局发布《新药I期临床试验申请技术指南》《创新药(化学药)Ⅲ期临床试验药学研究信息指南》《证候类中药新药临床研究技术指导原则》等指导原则17个(详见附件6),完成公开征求意见的7个,正在制修订的66个;持续推进国外指导原则翻译转化工作,翻译完成指导原则73个。三是加强审评信息化系统建设,推进药品电子通用技术文档(eCTD)资料管理系统建设,顺利完成供应商招标采购工作,制定eCTD工作方案,完成系统需求分析,为实现按eCTD要求进行电子申报和审评打好基础。
(四)继续强化廉政及队伍建设
一是完善利益冲突防范制度。针对审评人员队伍迅速扩增、新招录人员药企工作背景复杂的实际情况,组织开展了职工及近亲属在药企投资持股兼职取酬专项清理,建立了防范利益冲突的长效机制,印发了《药审中心廉政风险点及防控措施》《药品审评中心防范利益冲突若干规定》,细化了具体的利益冲突情形,对与申请人见面、通电话、发邮件等重点部位制定了专门的规定,利用技术手段实现纪检力量嵌入内网审评系统,实现信息浏览痕迹可追溯,确保纪检机构对审评权力运行的全程监督。
二是加大人员培训力度,拓宽培训渠道,与国内高校、科研院所、地方药检所、专业培训机构合作建立培训平台;推行新入职人员首次岗位级别认定工作及新的职工绩效工资体系,建立公平合理、透明公开的绩效分配制度,持续推动职称评审工作改革,制修订职工在职学历学位教育和学术兼职管理办法,通过一系列措施有效调动了员工积极性。
(五)切实抓好典型项目政府购买服务改革试点工作
根据《财政部关于在部分中央部门开展典型项目政府购买服务改革试点工作的通知》(财综〔2015〕100号)文件精神,原总局选取药品注册审评服务为典型项目进行试点,政务购买服务内容包含的技术审评项目有新药临床申请、新药上市申请、仿制药申请、仿制药一致性评价申请、补充申请。原总局购买药品审评服务改革试点于2017年实施,2018年药审中心继续作为政府购买服务改革试点,在财政部、国家局的支持领导下,积极推进典型项目政府购买服务改革,持续深化人事制度改革,探索灵活用人机制,加强审评支持基础建设、提高审评支持水平,多措并举,齐心协力,逐步化解了审评技术力量严重不足的矛盾,圆满完成了解决注册申请积压和2018年实现各类注册申请基本按规定时限审评审批的工作目标,为全面贯彻落实42号和44号文件审评审批制度改革任务提供了坚强有力保障。
五、2019年重点工作安排
2018年,药品审评工作取得了一定进展,但仍存在着一些问题:一是如何进一步完善审评管理制度和标准体系,提升审评质量和效率,提高人民群众的满意度和获得感,需要深入思考研究;二是审评人才结构与改革要求不相适应,审评能力亟待提升;三是药品审评审批制度改革任重道远,部分改革措施还未完全落实到位。
2019年药审中心将紧密围绕总局工作部署,重点开展以下工作:
(一)积极推动各项改革任务落实落地
认真贯彻落实中央印发的《关于改革和完善疫苗管理体制的意见》精神,严格疫苗技术审评,鼓励疫苗研发创新,进一步完善疫苗技术指南体系;强化与申请人沟通交流,以团队化工作模式,确保临床试验申请60日默示许可制度顺利推进;进一步推进仿制药一致性评价工作,以临床需求为核心,分类处理、分别施策,加快审评进度;结合中药的特点和实际积极支持中药传承和创新;规范药品审评审批信息公开工作,加大公开力度,回应社会关切;加快临床急需和罕见病治疗药品的审评,促进境外新药尽快在境内上市。
(二)依法履职尽责做好药品审评审批工作
建立按时限审评常态化工作机制,充分发挥项目管理人督导作用,加强审评任务督导和协调;制定合规风险评估细则,统一审评检查尺度;继续完善临床期间药物警戒的监测、处理、应急程序和体系建设,加强对高风险品种临床试验的安全性监管;以问题为导向,不断提升全员质量意识,通过建立探索性质量目标、质量管控奖惩机制等措施,提高审评质量;结合审评审批新形势新要求,统筹推进中心指导原则体系建设。
(三)继续推动审评体系与国际接轨
推进eCTD系统建设,为按eCTD要求申报和审评创造条件;加快推动ICH指导原则在中国转化实施,参与ICH国际协调和指导原则制定,组织协调开展ICH指导原则培训工作;科学接受境外临床试验数据,加快临床急需进口药品国内上市。
(四)继续推进现代化审评体系与人才队伍建设
加大培训力度,统一部署谋划,制定适合中心审评工作的培训大纲,制定岗前培训和继续教育的具体方案;不断提高培训工作的针对性和系统性;继续探索构建合理的绩效考核体系,进一步完善中心职务职称评定的规则与标准,畅通职业发展通道,充分发挥好其专业人才评价“指挥棒”作用;加强学科建设,跟踪学术前沿技术标准,加快推进指导原则体系建设;严把药品上市技术审评关,定期排查风险点,制定风险防范措施,抓好内外部监督,切实规范审评人员的自由裁量权使用,做到利剑高悬,监督常态化,营造风清气正的审评环境。
一万年太久,只争朝夕。改革无限,创新无限,发展无限。药审中心将以习近平新时代中国特色社会主义思想为指导,坚持以人民为中心的发展思想,全面贯彻“四个最严”要求,抓住机遇,迎接挑战,驰而不息地抓改革、强基础、重质量、提效率,全面发力、多点突破、蹄疾步稳,把药品审评工作做得更精、更专、更细、更优、更强,加快建设具有国际影响力的、权威的、公众信赖的药品审评机构,全力维护公众用药安全,全力满足公众临床需要,始终做公众健康的坚强守护者。
关键词: 2018年度药品审评报告


















































 营业执照公示信息
营业执照公示信息